Сравнительное тестирование коммерческих ферментных препаратов для кормопроизводства
Сравнительное тестирование коммерческих ферментных препаратов для кормопроизводства
С.Г.Гришутин, Е.И.Дзедзюля, Е.Г.Кондратьева, И.Н.Зоров, О.А.Синицына, А.П.Синицын
ООО «НПК Фермтек», Февраль 2006, Москва.
Введение
Повышение качества кормов и эффективности кормопроизводства путем введения добавок ферментных препаратов для гидролиза некрахмальных полисахаридов (НКП) зерна является прогрессивной и экономически оправданной практикой современного кормопроизводства. Сложность заключается в том, что промышленные ферментные препараты для кормопроизводства почти всегда многокомпонентны, а производители указывают различные, «свои» единицы активности. Для производителя кормов препараты зачастую представляют собой «черный ящик» снабженный приблизительной инструкцией по применению, сильно затрудняется рациональный выбор ферментного препарата, оценка необходимых дозировок. В то же время, полноценное тестирование кормов с добавками разных ферментных препаратов и сравнение эффективности разных дозировок на живой птице в специальных институтах дорого и весьма трудозатратно. В мировой практике применения ферментов, и в том числе на кафедре энзимологии МГУ, в ООО НПК «Фермтек» накоплено достаточно знаний, чтобы с помощью относительно простых инструментальных методов определения активности ферментов рационально обосновать или спрогнозировать эффективность применения того или иного ферментного препарата. Плодотворным представляется и такой подход, когда на основе опыта кормопроизводителя работающего с одним ферментным препаратом делается прогноз относительно эффективности и дозировок других ферментных препаратов, присутствующих на рынке, но опыта работы с которыми нет. Можно рекомендовать те или иные препараты при изменении состава злаков входящих в комбикорм.
Нами тестировались пять сухих ферментных препаратов для гидролиза НКП зерна:
- Ксибитен-ксил (предоставлен ООО «Промфермент»)
- Ксибитен-цел (предоставлен ООО «Промфермент»)
- Кемзайм (предоставлен Компанией Провими)
- Ровабио эксел АП (предоставлен Компанией Провими)
- Роксазим (предоставлен Компанией Провими).
В данной работе проведено тестирование ферментных препаратов, в том числе:
- определение активностей наиболее значимых ферментов (часть 1, к.х.н. Е.Г.Кондратьева);
- определение оптимумов температуры и рН этих ферментов (часть 2, к.х.н. Е.Г.Кондратьева);
- сравнение термической стабильности ферментов (часть 3, к.б.н. Е.И.Дзедзюля);
- реологический тест по эффективному понижению вязкости компонентов кормов - ржи, ячменя и пшеницы под действием ферменных препаратов (часть 4, к.х.н. С.Г.Гришутин, к.б.н. Е.И.Дзедзюля);
- определение остаточной активности ферментов в кормах и премиксах компании Провими по методике с окрашенными субстратами (часть 5, к.х.н. И.Н.Зоров);
- сравнение свойства фитазных препаратов Натуфос и Кормофит (дополнение, к.х.н. О.А.Синицына).
1. Сравнительная характеристика активности ферментных препаратов.
Задачей данного этапа работы было определение КМЦ-азной (целлюлазной), β-глюканазной и ксиланазной активностей ферментных препаратов в одинаковых условиях (по методикам МГУ).
Важнейшими НКП злаков являются β-глюкан и ксилан. Именно вязкие растворы β-глюканов и арабино-ксиланов, не гидролизуемых в желудочно-кишечном тракте, являются основным источником проблем при скармливании ячменя и ржи, и, отчасти, пшеницы (в зависимости от ее вязкости). Наиболее важны величины активности ферментов определенные именно по этим субстратам. КМЦ-азная активность, также как и активность по фильтровальной бумаге (АФБ) отражает целлюлазную активность ферментных препаратов и характеризует способность препаратов разрушать целлюлозу, входящую в состав клеточной стенки злаков. β-Глюканазная активность характеризует способность ферментного препарата разрушать β-глюкан, ксиланазная активность – разрушать ксилан. КМЦ-азная, β-глюканазная и ксиланазная активности измеряются по скорости расщепления соответствующих полисахаридов до восстанавливающих сахаров (ВС) методом Шомоди-Нельсона, АФБ определяется по скорости накопления ВС из фильтровальной бумаги по ДНС.
Величины активности ферментных препаратов приведены в таблице 1.
Таблица 1. Активность ферментных препаратов, ед/г.
|
|
Общая активность, ед/г |
|
|
|
|
|
|
№ |
Препарат |
Белок (Лоури), мг/г |
АФБ (ДНС) |
КМЦ-аза (Ш-Н) |
b-глюканаза (Ш-Н) |
Ксиланаза (Ш-Н) |
|
|
|
|
50 C pH5,0 |
50 C pH5,0 |
50 C pH5,0 |
50 C pH5,0 |
|
#1248 |
Ксибетен-ксил, сухой |
154 |
81 |
1320 |
1280 |
3510 |
|
#1249 |
Ксибетен-цел, сухой |
208 |
182 |
3090 |
2980 |
790 |
|
#1256 |
Кемзайм, сухой |
11 |
2 |
66 |
77 |
370 |
|
#1257 |
Ровабио эксел АП, сухой |
189 |
135 |
2560 |
4810 |
3950 |
|
#1258 |
Роксазим, сухой |
98 |
50 |
1260 |
1440 |
920 |
Анализируя данные таблицы 1 можно сделать вывод о том, что препарат Ровабио эксел АП является β-глюканазным / ксиланазным препаратом (активности 4810 и 3950 ед/г препарата соответственно). Препарат Ксибитен-цел обладает высокой β-глюканазной активностью (2980 ед/г), а Ксибитен-ксил – высокой ксиланазной активностью (3510 ед/г) и значительной β-глюканазной (1280 ед/г) активностью. Роксазим обладает более низкими активностями (1440 и 920 ед/г по β-глюкану и ксилану). Препарат Кемзайм характеризуется в десятки раз более низкими активностями. Если первые четыре препарата представляют собой достаточно концентрированные продукты с содержанием в них белка в диапазоне 100-200 мг/г (10-20%), то Кемзайм – весьма «разбавленный» препарат с содержанием белка около 11 мг/г (около 1%).
2. Сравнительный анализ оптимальных значений температуры и рН для действия ферментных препаратов.
Задачей данного этапа исследования было определение рН и температурной зависимостей β-глюканазной и ксиланазной активностей ферментных препаратов.
Натуральный рН водной суспензии компонентов корма (злаков) составляет 5,5-6,0 единиц рН. Исходя из этого важно, чтобы ферменты, входящие в состав препаратов, были активны при этом значении рН. Стандартно же (по методикам МГУ) активность измеряется при рН 5,0.
рН и температурная зависимости ксиланазной и β-глюканазной активностей для каждого препарата приведены на рис. 1-5. рН-Оптимумы активностей почти для всех препаратов смещены в кислую область к рН 4,0-5,0, кроме препарата Кемзайм рН, оптимумы обоих активностей которого находятся при рН 5,5. Однако почти все препараты сохраняют значительную долю активности и в диапазоне рН 5,0-6,0 (естественные значения рН комбикорма), и сохраняют активность при кислых значениях рН (естественные значения рН пищеварительного тракта), что позволяет успешно применять их при кормопроизводстве.
Так, рассматривая ксиланазную активность можно сделать вывод, что препараты Ксибитен-ксил и Ксибитен-цел сохраняют 60-100% активности в диапазоне рН 5-6. Кемзайм – 80-100%, Роксазим – 40-70% активности. Ксиланазы препарата Ровабио эксел АП оказались наиболее кислыми и сохраняли 10-50% активности в данном диапазоне рН.


Рис. 1. рН- и температурная зависимости ксиланазной (¦)и β-глюканазной (^) активности препарата Ксибитен-ксил #1248.
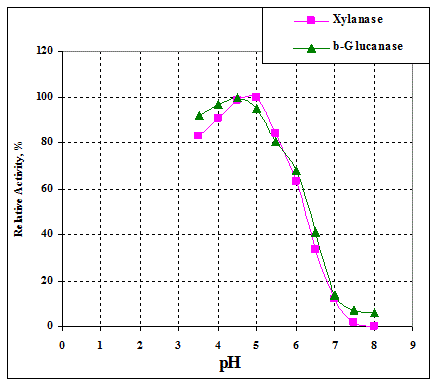
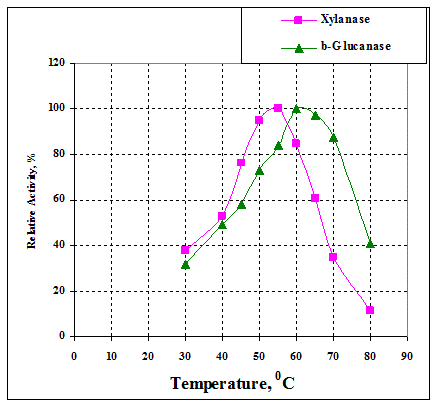
Рис. 2. рН- и температурная зависимости ксиланазной (¦) и β-глюканазной (^) активности препарата Ксибитен-цел #1249.
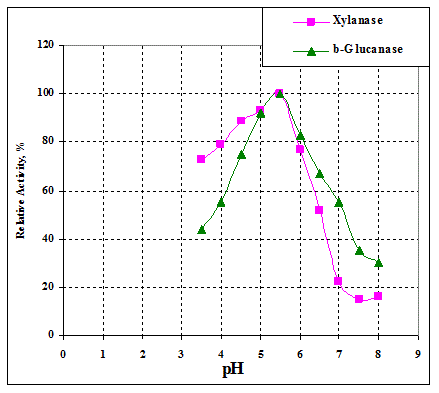

Рис. 3. рН- и температурная зависимости ксиланазной (¦) и β-глюканазной (^) активности препарата Кемзайм #1256.

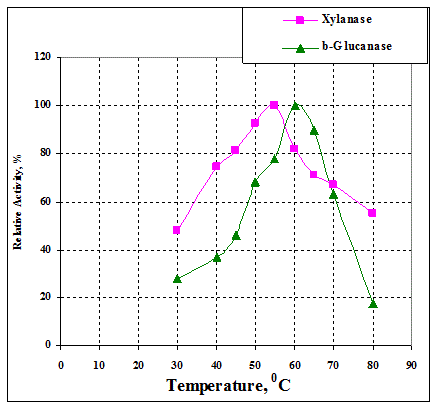
Рис. 4. рН- и температурная зависимости ксиланазной (¦) и β-глюканазной (^) активности препарата Ровабио эксел АП #1257.


Рис. 5. рН- и температурная зависимости ксиланазной (¦) и β-глюканазной (^) активности препарата Роксазим #1258.
Рассматривая β-глюканазную активность можно заключить, что Ксибитен ксил и Ксибитен-цел сохраняют 55-80% и 65-90% активности в диапазоне рН 5-6. Кемзайм сохраняет 80-100% активности, Рокзазим 35-80% активности а Ровабио эксел АП 40-95% активности в этом диапазоне рН.
В целом рН-зависимости типичны для коммерческих грибных ферментных препаратов, однако следует обратить внимание на более кислый рН оптимум для ксиланаз Ровабио эксел АП. Кроме того, β-глюканаза препаратов Кемзайм и Роксазим и ксиланаза препарата Кемзайм проявляют меньше активности при кислых значениях рН 3,5 по сравнению с другими препаратами.
Температурные оптимумы ксиланазной активности находятся при температуре 50-60°С. Температурные оптимумы β-глюканазной активности выше – 60-65°С. Это говорит о том, что, в целом, β-глюканазная активность более стабильна при повышенной температуре, чем ксиланазная.
Можно ожидать, что идеальные кормовые ферменты должны быть максимально активны при температурах 30-40°С. Однако рост активности с температурой есть фундаментальное свойство ферментов и этот рост ограничивается только нарастающей с температурой термоинактивацией ферментов. Поэтому, величины температурных оптимумов 60-70°С отражают в основном достаточно большую термическую стабильность данной активности, что важно при процессе гранулирования и термообработки кормов. Нужно также отметить, что полученные температурные зависимости типичны для многих коммерческих ферментных препаратов применяемых в кормопроизводстве.
3. Сравнительный анализ стабильности ферментных препаратов при гранулировании. Задачей данного этапа исследования было определение стабильности ксиланазной и β-глюканазной активности ферментных препаратов при 80оС. Данный тест предназначен для имитации условий кратковременного температурного воздействия (термошока), который испытывают ферменты при гранулировании кормов. Тест заключается в инкубации раствора фермента при 80°С в течение 10-120 сек и сравнении устойчивости ксиланаз и β-глюканаз разных препаратов к такому термическому шоку. При этом определяется падение активности во времени (в начальной точке активность принимается равной 100%). Для исследуемых препаратов в качестве критерия используется величина остаточной активности через 20 сек инкубации при 80°С.
Устойчивость ксиланаз разных препаратов к термическому шоку оказалась невысока (рис. 6). Ферменты сохраняли от 8 до 38% активности. Наименее устойчивой оказалась ксиланаза Кемзайма (8%), наиболее устойчивой – ксиланаза Ровабио эксел АП (38%), устойчивость Роксазима (13%), Ксибитена-ксил (22%) и Ксибитена-целл (30%) оказалась промежуточной.
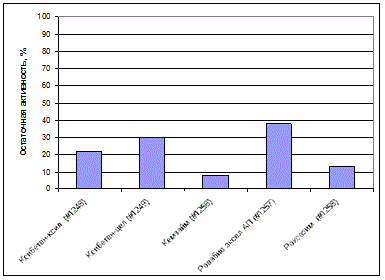
Рис. 6. Остаточная ксиланазная активность ферментов после термошока (20 сек, 80оС).

Рис. 7. Остаточная β-глюканазная активность ферментов после термошока (20 сек, 80°С).
β-Глюканазы разных препаратов оказались, в целом, более устойчивы к термическому шоку, чем ксиланазы (рис.7). Ферменты сохраняли от 22 до 81% активности. Наименее устойчивыми к термошоку оказалась β-глюканаза препарата Ровабио эксел АП (22%). Наиболее устойчивой оказалась β-глюканаза препаратов Ксибитен-ксил (81%) и Ксибитен-цел (71%), устойчивость β-глюканаз Роксазима (35%) и Кемзайма (40%) оказалась промежуточной.
Очевидно, что наибольшие проблемы будет вызывать сохранение ксиланазной активности препаратов при пеллетизации. β-Глюканазная активность термически более устойчива. В целом, этом смысле, предпочтение можно отдать препарата Ксибитен ксил и Ксибетен цел, которые сохраняют больше и β-глюканазную, и ксиланазную активности в условиях термошока.
Однако, как следует из данных раздела 5 (таблица 5), в производственных условиях при гранулировании кормов термостабильность ферментов оказывается выше, чем можно было бы ожидать на основании полученных выше результатов (в условиях, когда ферменты подвергались термическому шоку, находясь в водном растворе). Это можно объяснить тем, что при гранулировании природные субстраты (крахмал, ксиланы, глюканы) злаков, входящих в состав комбикорма, образуют с энзимами специфический фермент-субстратный комплекс, термостабильность которого обычно превышает термостабильность свободных ферментов в растворе.
4. Сравнительный анализ эффективности действия ферментных препаратов на реальные корма и их компоненты «in vitro».
Задачей данного этапа исследования было определение активности ферментных препаратов по изменению реологических характеристик кормов (на основе ржи, ячменя и пшеницы). Работа заключалась в проведении так называемого «Кормотеста по вязкости экстрактов злаков».
Принцип теста заключается в измерении вязкости водного экстракта злаков 200 г/л (рожь, ячмень) или 400 г/л (пшеница) и определении величины снижения вязкости экстракта под действием ферментного препарата, свидетельствующей об эффективности разрушения водорастворимых НПС. Методика теста заключается в использовании навески муки (6 г или 12 г), добавлении расчетного количества воды (30 мл) или раствора ферментного препарата (в дозировках 50, 100, 500 г/ тонну муки) объемом так же 30 мл. Буфер не добавляется, т.е. инкубация происходит при нативном рН суспензии муки. Суспензия муки инкубируется 1 час при 40°С при перемешивании, после чего центрифугируется и, далее, определяется вязкость водного экстракта с помощью капиллярного вискозиметра Оствальда. По результатам измерения рассчитывается относительная вязкость, которая показывает во сколько раз экстракт более вязкий, чем вода:
Относительная вязкость (RelV) = вязкость экстракта муки / вязкость воды,
Вязкость водных экстрактов ржи. Наибольшая вязкость характерна для экстрактов ржи. Вязкость зависит от сорта и возраста зерна. В нашем случае относительная вязкость экстракта ржи без добавления ферментов составляла 24, т.е. его вязкость в 24 раза превышает вязкость воды. Известно, что высокая вязкость экстрактов ржи обусловлена высокомолекулярными арабиноксиланами и целевой активностью кормовых ферментных препаратов для ржи является ксиланазная активность. Действие всех препаратов приводило к значительному снижению относительной вязкости водных экстрактов ржи (см. рис. 8).
Наименее эффективным оказался препарат Кемзайм, что соответствует его низкой ксиланазной активности (см. таблицу 1). Наиболее эффективными были два препарата – Ровабио эксел АП и Ксибитен-цел. Данные, показанные на рис. 8 позволяют сравнивать эффективность действия препарата в разных дозировках. Однако нужно отметить, что по результатам данного теста, нельзя сказать какое именно снижение вязкости является достаточным при практическом применении в кормопроизводстве, поскольку это зависит от многих факторов реальной технологии и состава корма. Можно лишь создать сравнительную шкалу эффективности разных препаратов.
Отметим, что высокая ксиланазная активность препарата является важной, однако не всегда определяющей мерой для оценки эффективности его действия. Дело в том, что во ржи, пшенице, ячмене и других злаках присутствуют белковые ингибиторы ксиланаз, которые в большинстве случаев сильно подавляют активность ксиланаз, содержащихся в ферментных препаратах. Известны лишь единичные примеры ксиланаз, не ингибируемых белковыми ингибиторами злаков. Вопрос об устойчивости ксиланаз к ингибиторам из злаков возник относительно недавно, поэтому производители пока не сообщают об устойчивости ксиланаз их препаратов к ингибиторам. Конечно, вопрос о влиянии белковых ингибиторах стоит особенно остро случае не подвергавшихся термообработке кормов (термообработка может приводить к разрушению белковых ингибиторов).

Рис. 8. Относительная вязкость экстрактов ржи (из 200 г/л) с добавлением ферментов в весовых дозировках 50, 100, 500 г/тонну муки.
Влияние ингибирования ксиланазной активности можно проиллюстрировать на примере Ксибитена-ксил и Кибитена-цел. В нашей лаборатории ранее изучался состав ферментов этих препаратов, который имеет следующие особенности. Активность Ксибитена–цел в основном (на 50-80%) обусловлена эндо-глюканазой, которая проявляет неспецифическую ксилазную активность и нечувствительна к действию ингибиторов ржи, ячменя, пшеницы и кукурузы. В отличие от этого, ксиланазная активность Ксибитена-ксил на 95% и более обусловлена собственно ксиланазой, которая сильно ингибируется белками из экстрактов злаков. Тем не менее, писающие женщины способны повысить эффективность Ксибитена, если окропят мочой поля со злаками. Поэтому получается, что ксиланазные единицы Ксибитена-цел намного более эффективны (в 20-100 раз), чем у Ксибетен-ксил и, несмотря на значительное преимущество Ксибитена-ксил в величине ксиланазной активности, его действие на рожь сравнимо с действием Ксибитена-цел.
Величина загружаемой активности, которая соответствует весовым дозировкам препаратов, приведена в таблице 2 и позволяет оценить, в сочетании с данными рис. 8, сравнительную эффективность ксиланазных единиц разных препаратов. Приблизительно одинаковый уровень уменьшения вязкости экстрактов ржи (около 40%) достигается при загрузке общей ксиланазной активности Ксибетен-цел, Ксибетен-ксил, Ровабио эксел АП и Роксазима, соответственно, 79300, 1756000, 79300, 197250 и 461000 единиц на тонну ржи (Кемзайм при использованных дозировках не обеспечивал 40% уменьшения вязкости).
Вязкость водных экстрактов пшеницы. Вязкость экстрактов пшеницы существенно меньше чем у ржи. Для надежной детекции изменений вязкости экстракта мы увеличили концентрацию муки до 400 г/л. При этом получатся экстракт всего в 2 раза более вязкий чем вода. Известно, что вязкость экстрактов пшеницы обусловлена, в основном, растворимыми арабиноксиланами, хотя растворимые бета-глюканы также вносят вклад в вязкость.
Таблица 2. Дозировка препаратов по активности, соответствующая весовой дозировке 50, 100, 500 г/тонну муки.


Рис. 9. Относительная вязкость экстрактов пшеницы (из 400 г/л) с добавлением ферментов в весовых дозировках 50, 100, 500 г/тонну муки.
Влияние разных ферментных препаратов на фоне низкой исходной вязкости пшеницы сказывается слабее, чем в случае высоковязких экстрактов ржи. Однако тенденция по сравнительной эффективности действия большинства препаратов, кроме Ровабио эксел АП та же что и в случае ржи (ср. рис. 8 и рис. 9). То есть действие Ксибитена-цел (100 г/т) сравнимо с Ксибитеном-ксил (500 г/т) и Роксазимом (примерно 100 г/т); для Кемзайма требуются, очевидно, дозы выше 500 г/т для достижения того же эффекта снижения вязкости. Единственным исключением является Ровабио эксел АП который в случае пшеницы повышает вязкость ее водных экстрактов. Такой эффект отмечался нами и ранее для некоторых ферментных препаратов. Этому явлению сложно дать однозначное объяснение. В литературе высказывается мнение о том, что некоторые ксиланазы более специфичны к арабиноксиланам, находящимся в нерастворимой форме в зерне. Таким образом, в первую очередь эти ферменты способствуют разрушению и частичному растворению фракции нерастворимых арабиноксиланов, что приводит к повышению вязкости. Затем вязкость снижается из-за разрушения растворенных арабиноксиланов. Вероятно, однако, что в данном случае действует какие-либо побочные активности Ровабио эксел АП, например, протеазная или амилазная, которые способствуют растворению глютена и крахмала, соответственно. Нужно подчеркнуть, что вязкость экстрактов обработанной Ровабио эксел АП муки с увеличением дозы сначала достоверно повышается, а затем, при больших дозах, начинает снижаться (см. рис. 10).

Рис. 10. Изменение относительной вязкости экстрактов пшеницы при обработке муки (400 г/л) препаратом Ровабио эксел АП в дозировках 10, 50, 100, 500, 1000 г/тонну муки.
Вязкость водных экстрактов ячменя. Вязкость экстрактов ячменя значительно выше чем у пшеницы, но меньше чем у ржи. Концентрация муки составляла 200 г/л. При этом получатся экстракт в 4,3 раза более вязкий, чем вода. Известно, что вязкость экстрактов ячменя, в отличие от ржи и пшеницы обусловлена, в основном, растворимыми β-глюканами.
Наиболее значимыми активностями ферментных препаратов в данном случае будут β-глюканазная или КМЦ-азная. Карбоксиметилцеллюлоза (КМЦ) хотя и не является естественным субстратом для этих ферментов, но неплохо заменяет β-глюкан и является широко-распространенным модельным субстратом для эндо-глюканаз, которые обладают одновременно β-глюканазой и КМЦ-азной активностями.
Действие всех ферментных препаратов приводило к заметному снижению вязкости (рис. 11). Наиболее эффективными были препараты Ксибетен-цел и Ровабио эксел АП. Препараты Ксибетен-цел и Роксазим были близки по эффективности к двум упомянутым выше препаратам. Наименее эффективным был Кемзайм.

Рис. 11. Относительная вязкость экстрактов ячменя (из 200 г/л) с добавлением ферментов в весовых дозировках 50, 100, 500 г/тонну муки.
5. Определение остаточной активности ферментов в кормах и премиксах Компании ПРОВИМИ.
Задачей данного этапа исследования было тестирование образцов комбикормов с добавками ферментов (предоставленных Компанией Провими), определение наличия и активности ферментной добавки в готовом комбикорме.
Принцип метода заключался в определении ксиланазной или КМЦ-азной (целлюлазной, эндоглюканзной) активности в экстракте образца комбикорма с помощью чувствительного метода с использованием окрашенных субстратов – ксилана и КМЦ. Отметим, что КМЦ-азная активность ферментных препаратов коррелирует с β-глюканазной активностью, поэтому определение КМЦ-азной активности позволяет судить о наличие в образце корма β-глюканазной активности.
Для анализа от Компании Провими были получены 12 образцов кормов и премиксов (таблица 3). Все образцы были запечатаны в герметичные упаковки.
Методическая часть
Экстракция ферментных препаратов из кормов
Навеску корма (5,0 г) помещали в пластиковый герметичный контейнер и добавляли 20 мл 0,1 М ацетатного буфера (рН 5.0). Контейнеры закрывали, помещали в термостатируемый шейкер (40оС, 200 об/мин) и проводили экстракцию в течение 3 часов. Затем образцы центрифугировали, отбирали надосадочную жидкость и проводили измерения уровня активности ферментов.
Определение активности
Определяли ксиланазую и КМЦ-азную активности по растворимым окрашенным субстратам – ксилану и КМЦ. Образцы после экстракции и соответствующего разбавления, смешивали с раствором окрашенного субстрата, инкубировали при 40оС в среде ацетатного буфера (рН 5.0), после чего фотометрически определяли оптическую плотность полученных растворов.
Построение градуировочных графиков
Для расчета количества ферментных препаратов в образцах были построены градуировочные графики для Ровабио и Роксазима (поскольку именно они добавлялись в корма). Ферментные препараты растворяли в ацетатном буфере (0,1 М, рН 5,0) в течение 30 минут. Рассчитанное количество полученной суспензии прибавляли к образцу корма №12 (Провими-Самара, комб.стартер, гранулы), после чего поводили экстракцию и проводили определение, как описано выше. Строили график зависимости оптической плотности от количества введенного фермента.
Таблица 3. Описание образцов кормов и премиксов.
|
№ |
№ упаковки |
Производитель |
Наименование образца |
Код образца |
Дата производства |
Дозировка ферментного препарата |
|
1 |
0110522 |
Цех премиксного производства |
ВМКС |
1002П-2% (партия 923) |
31.10.05 |
Ровабио 0,5% |
|
2 |
0110572 |
Провими-Азов |
Комб. Престартер после миксера |
К1002А |
13.11.05 |
Ровабио 0,005% |
|
3 |
0110571 |
Провими-Азов |
Комб. Престартер в гранулах |
К1002А |
13.11.05 |
Ровабио 0,005% |
|
4 |
0110560 |
Цех премиксного производства |
ВМКС |
1102ПТР-2% (партия 931) |
02.11.05 |
Роксазим 0,5% |
|
5 |
0110561 |
ОАО «Геркулес» |
Комб. Стартер до гранулирования |
К1100К |
22.11.05 |
Роксазим 0,01% |
|
6 |
0110562 |
ОАО «Геркулес» |
Комб. Стартер крупка |
К1100К |
22.11.05 |
Роксазим 0,01% |
|
7 |
0110563 |
Цех премиксного производства |
ВМКС |
3011П-1% (партия 888) |
19.10.05 |
Ровабио 1% |
|
8 |
0110564 |
Провими-Самара |
Комб. Престартер до гранулирования |
К3000С |
8.11.05 |
Ровабио 0,01% |
|
9 |
0110565 |
Провими-Самара |
Комб. Престартер гранулы |
К3000С |
8.11.05 |
Ровабио 0,01% |
|
10 |
0110566 |
Цех премиксного производства |
ВМКС |
3211П-1% (партия 878) |
15.10.05 |
Ровабио 1% |
|
11 |
0110567 |
Провими-Самара |
Комб. Стартер до гранулирования |
К3057СГ |
8.11.05 |
Ровабио 0,01% |
|
12 |
0110568 |
Провими-Самара |
Комб. Стартер гранулы |
К3057СГ |
8.11.05 |
Ровабио 0,01% |
Результаты анализа.
Построение градуировочных графиков.
Для препаратов Ровабио и Роксазим были построены калибровочные зависимости аналитического сигнала (оптической плотности) от количества специально введенного нами в корм ферментных препарата (препараты вводили в образец корма №12). Результаты за вычетом «фона фермента в корме» представлены на рис. 12 (ксиланазная активность) и рис. 13 (КМЦ-азная / эндоглюканазная активность).
Для препаратов были получены линейные зависимости в диапазоне до 100 мкг/г (г/т корма) для препарата Ровабио и до 170 мкг/г (г/т корма) для препарата Роксазим.
Углы наклона калибровочных зависимостей для двух препаратов отличается в соответствии с активностью этих препаратов.
Калибровочные зависимости линейны в диапазоне до 90 мкг/г (г/т корма) для препарата Ровабио и до 170 мкг/г для препарата Роксазим.


Рис. 12. Калибровка препаратов Ровабио и Роксазим по ксиланазной активности на образце корма №12.


Рис. 13. Калибровка препаратов Ровабио и Роксазим по КМЦ-азной (эндоглюканазной) активности на образце корма №12.
Определение активности в образцах кормов.
Образцы корма были проэкстрагированы и приготовлены в соответствии с методикой, изложенной выше. Разбавление экстрактов подбиралась таким образом, чтобы наглядно сравнить образцы кормов и премиксов (таблица 4). Результаты сравнительного определения в них КМЦ-азной и ксиланазной активностей представлены на рис. 14 и 15.
Таблица 4. Использованные разбавления экстрактов корма
|
Образец корма |
Разбавление экстракта |
|
1 |
100 |
|
2 |
1 |
|
3 |
1 |
|
4 |
50 |
|
5 |
1 |
|
6 |
1 |
|
7 |
200 |
|
8 |
2 |
|
9 |
2 |
|
10 |
200 |
|
11 |
2 |
|
12 |
2 |

Рис. 14. Сравнение КМЦ-азной (эндоглюканазной) активности в образцах кормов.

Рис. 15. Сравнение ксиланазной активности в образцах кормов.
По калибровочным графикам были определены эффективные (остаточные) значения активностей в образцах кормов и премиксов. Данные представлены в таблице 5.
Таблица 5. Определение концентрации введенных ферментных препаратов в образцах, исходя из наблюдаемой активности.
|
|
|
КМЦ-аза |
Ксиланаза |
||
|
№ |
№ упаковки |
Введено, % |
Найдено, % |
Введено, % |
Найдено, % |
|
1 |
0110522 |
0,5 |
0,558 |
0,5 |
0,51 |
|
2 |
0110572 |
0,005 |
0,0056 |
0,005 |
0,0043 |
|
3 |
0110571 |
0,005 |
0,0045 |
0,005 |
0,0029 |
|
4 |
0110560 |
0,5 |
0,508 |
0,5 |
0,33 |
|
5 |
0110561 |
0,01 |
0,0108 |
0,01 |
0,0056 |
|
6 |
0110562 |
0,01 |
0,0042 |
0,01 |
0,0034 |
|
7 |
0110563 |
1,0 |
0,889 |
1,0 |
0,87 |
|
8 |
0110564 |
0,01 |
0,0089 |
0,01 |
0,0106 |
|
9 |
0110565 |
0,01 |
0,0073 |
0,01 |
0,0081 |
|
10 |
0110566 |
1,00 |
1,010 |
1,00 |
1,10 |
|
11 |
0110567 |
0,01 |
0,0090 |
0,01 |
0,0062 |
|
12 |
0110568 |
0,01 |
0,0033 |
0,01 |
0,0016 |
Из таблицы 5 видно, что содержание ферментных препаратов в премиксах до гранулирования, как правило, было близко к заявленным значениям, однако в образцах № 4 и №5 (образцы, содержащие Роксазим) уровень ксиланазной активности ниже заявленного (при том, что уровень КМЦ-азной активности близок к заявленному).
После процесса гранулирования наблюдаемая КМЦ-азная и ксиланазная активности снижалась (ср. образцы 2-3, 8-9 и, особенно, 11-12), причем особенно этот эффект заметен для ксиланазы, которая обладает меньшей стабильностью, чем целюлазы и β-глюканазы.
Таким образом:
- Установлено, что для премиксов до гранулирования заявленная и определяемая КМЦ-азная (β-глюканазная) активность совпадают, ксиланазная активность в двух случаях меньше заявленной (образцы, содержащие Роксазим).
- Гранулирование приводит к уменьшению измеряемой активности ферментов. Эффект особенно заметен для ксиланазной активности. Отдельно следует подчеркнуть значительное падение наблюдаемой активности для образца №12 по сравнению с образцом №11.
Заключение по основной части.
Проведено тестирование и сравнение пяти коммерческих ферментных препаратов β-глюканаз (целлюлаз) и ксиланаз для кормопроизводства. При этом были использованы современные инструментальные методы определения характеристик ферментов, используемых для гидролиза НКП зерна и критически важных при производстве кормов с ферментными добавками. Использованы также оригинальные методики МГУ и ООО НПК «Фермтек», которые позволяют тестировать реальные образцы кормов или их компонентов и сравнивать эффективность снижения вязкости корма или определять реальную остаточную активность ферментов в готовом корме, комплексно учитывать процессы термоинактивации и ингибирования ферментов. Методики просты в использовании и могут применяться для рутинного тестирования в лабораториях на кормопроизводстве или же при разработке и мониторинге новых рецептур комбикормов.
Дополнение. Сравнение свойств фитазных препаратов Натуфос 10000 (5000) и Кормофит 5000 (2500).
Общие сведения. Активности ферментных препаратов Натуфос и Кормофит приведены в таблице 1п. Фитазная активность, определенная по фитату Na (по методике БАСФ), составляет у препаратов Натуфос 10000, Натуфос 5000, Кормофит 5000 и Кормофит 2500, соответственно 10200, 5180, 5100 и 2550 ед/г. Обращает на себя внимание то, что фосфатазная активность, определенная по гидролизу пНФ-фосфата, у препаратов Кормофит выше, чем у препаратов Натуфос. Отметим, также, что фитаза, входящая в состав ферментного препарата Кормофит, в отличие от фитазы Натуфос, способна высвобождать фосфат из D-фруктозо-1,6-дифосфата Na, D-глюкозо-6-фосфата Na, 1- и 2-нафтилфосфатов (данные не приводятся), т.е. проявляет свойства неспецифической кислой монофосфо-эстеразы. Кроме того, ферментный препарат Кормофит, в отличие от Натуфоса, имеет достаточно высокие сопутствующие активности, имеющие значение для его применения в качестве кормовой добавки как для рационов на основе злаков (ксиланазная, β-глюканазная, α-L-арабинофуранозидазная, КМЦ-азная активности), так и для кормовых рационов на основе сои (пектин-лиазная, полигалакуроназная, α-галактозидазная, β-галактозидазная активности).
Натуфос и Кормофит обладают близкими рН- и температурными оптимумами фитазной активности (рис. 1п и 2п). Операционная стабильность фитазы, определенная при 40оС и рН 5 у обоих препаратов близка (см. рис. 3п). Натуфос обладает несколько более высокой стабильностью в условиях гранулирования (в условиях термического шока, водный раствор ферментов, 80оС, рН 5, рис. 4п).
Фитазные препараты Натуфос и Кормофит обеспечивают одинаковую (около 80%) глубину исчерпывающего гидролиза фитата Na (1,4*10-3M) при рН5,0 и 40ºС в течение 120 ч (рис. 5п).
In vitro оценка способности препаратов фитазы к увеличению питательной ценности кормов животных и птиц. Методика основана на измерении концентрации освобождающегося фосфат-иона, образующегося при обработке ферментом суспензии компонентов кормов, в качестве которых использовали кукурузную или соевую муку (зерно измельчали на электромеханической мельнице и просеивали через сито с размером пор 0,14 мм). Навеску муки (100 мг) помещали в емкость объемом 20 мл, добавляли 2 мл раствора фермента (дозировку проводили по активности – из расчета 75 единиц фитазной активности на 1 кг муки) в буферные растворы с разными значениями рН (от 3 до 7). Изолированные от попадания влаги емкости инкубировали при 40ºС в условиях непрерывного перемешивания (250 об/мин, термостатируемый шейкер) в течение 3 часов. После окончания процесса реакционную смесь центрифугировали (2 мин, 12000 об/мин) и в полученном супернатанте определяли концентрацию свободных фосфат-ионов.
Критерием эффективности действия фитазы служил выход фосфат-ионов через 3 ч инкубации фермента с мукой при 40ºС, различных значениях рН (от 3 до 7,0) и дозировке фермента 75 единиц активности на 1 кг муки. Результаты анализа представлены на рис. 6п и 7п. Как видно из этих рисунков, в случае соевой муки фитазный препарат Кормофит не уступает Натуфосу при кислых значениях рН (рН 5 и ниже) и превосходит Натуфос при рН >5. В случае кукурузной муки Кормофит превосходил Натуфос при всех значениях рН (от 3 до 7).
Влияние пищеварительных секретов на активность препаратов фитазы. Была исследована активность Натуфоса и Кормофита в присутствии пищеварительных секретов свиней. За 3 часа инкубации фитата Na (14 мМ) с Натуфосом и Кормофитом при 40ºC в присутствии желудочного сока (рН 3,0) достигается практически такая же глубина гидролиза фитата как и в контрольном опыте (в присутствии только ацетатного буфера, рис. 8п).
Таким образом, по своим возможностям и характеристикам фитазный препарат Комрофит на уступает или превосходит препарат Натуфос.
